B. Berdasarkan Nomor Atom
a. Tabel Periodik Moseley
Pada 1911, Ernest Rutherford berhasil
menemukan salah satu partikel
dasar penyusun atom, yaitu proton. Dua tahun
kemudian, Henry Moseley
meneliti hubungan antara sifat suatu atom dan
jumlah protonnya (nomor atom)
menggunakan spektroskopi sinar-X. Ia
memplotkan frekuensi sinar-X dan
kenaikan
nomor atom.
Tabel periodik Moseley berhasil memperbaiki
kelemahan tabel periodik
Mendeleev. Dalam tabel periodik Mendeleev,
penempatan telurium (massa
atom 128) dan iodin (nomor atom 127) tidak
sesuai dengan kenaikan massa
atomnya. Namun, berdasarkan tabel periodik
Moseley, penempatan unsur
Te dan I
sesuai dengan kenaikan nomor atomnya.
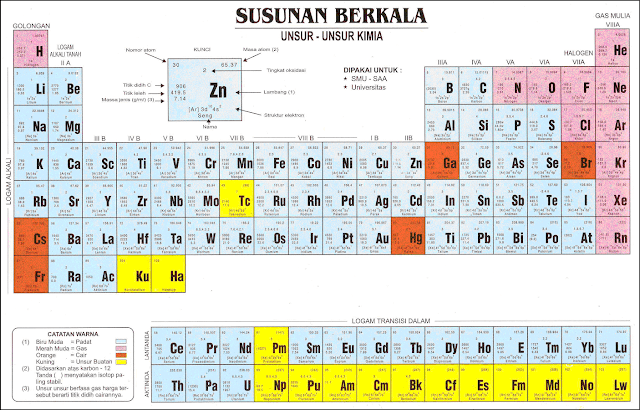
b. Tabel Periodik Modern
Hingga pertengahan abad ke-20, tabel periodik
Moseley diakui sebagai
tabel periodik modern. Pada 1940, Glenn
Seaborg berhasil menemukan unsur
transuranium, yaitu unsur dengan nomor atom 94–102.
Penemuan tersebut
menimbulkan masalah mengenai penempatan
unsur-unsur transuranium
dalam tabel periodik. Masalah itu akhirnya
terpecahkan dengan cara
membuat baris baru sehingga tabel periodik
modern berubah menjadi seperti
gambar
berikut.